Fécondation in vitro et ICSI
H. Lucas, F. Urner, N. Jaquenoud, I. Wagner
Les étapes de la fécondation in vitro conventionnelle et de l’ICSI sont identiques sauf en ce qui concerne la rencontre du spermatozoïde et de l’ovocyte. Dans la FIV, le spermatozoïde parvient lui-même à entrer dans l’ovocyte après avoir traversé les barrières qui l’entourent (le cumulus et la zone pellucide) tandis qu’en ICSI le spermatozoïde est placé directement à l’intérieur du cytoplasme de l’ovocyte.
Les étapes principales de la fécondation in vitro, avec ou sans ICSI, sont résumées dans le schéma ci-dessous :
JOUR 0
- Recueil des ovocytes
- Préparation du sperme
- Mise en contact des gamètes : FIV conventionnelle ou ICSI
JOUR 1
- Observation de la fécondation, présence de 2 pronuclei, stade: zygote
- Développement in vitro de 3 zygotes au maximum
- Congélation des zygotes surnuméraires
JOUR 2
JOUR 3
Recueil des ovocytesChaque ovocyte se trouve au sein d’un follicule ovarien qui se présente sous la forme d’un antre rempli de liquide (le liquide folliculaire). La croissance des follicules a été suivie par échographie durant la stimulation ovarienne et ce n’est qu’à partir d’une certaine taille que le médecin a décidé de « déclencher » l’ovulation avec une injection d’hCG. Entre cette injection et l’ovulation, 36h sont nécessaires à la maturation finale de l’ovocyte. Juste avant que l’ovulation ne se produise, le médecin aspire le contenu des follicules, qui est ensuite rapidement examiné sous le microscope, afin de trouver l'ovocyte et de le transférer dans un milieu de culture adéquat. Lorsque l’ovocyte est recueilli, il se trouve englobé dans des couches de cellules folliculaires qui forment le cumulus. Le diamètre de l’ovocyte est d’environ 0,1 mm alors que celui du complexe cumulus-oophorus est d’environ 1 mm.

Oocyte englobé dans son cumulus
Origine des spermatozoïdes
Dans la plupart des cas, ils proviennent de sperme éjaculé mais ils peuvent également provenir de l’épididyme (ponction épididymaire ou MESA) ou directement du testicule (biopsie testiculaire ou TESA). Par ailleurs, les spermatozoïdes humains peuvent être congelés avant utilisation, mais il faut savoir que la congélation entraîne une perte de la mobilité d’environ 50 %. En présence de spermatozoïdes de l’épididyme ou du testicule l’ICSI sera systématiquement choisie. En ce qui concerne le sperme éjaculé, c’est principalement la qualité du spermogramme qui déterminera le type de traitement à proposer au couple.
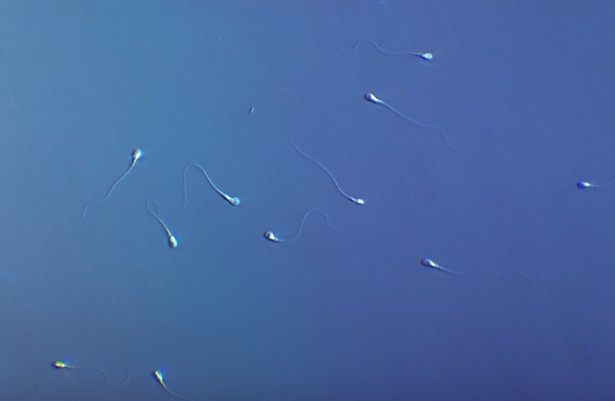
Spermatozoïdes nageant dans un milieu de culture
Spermatozoïdes éjaculésL’éjaculat est produit juste après le recueil des ovocytes. Le but de la préparation du sperme éjaculé est d’éliminer le plasma séminal et de sélectionner une population de spermatozoïdes mobiles et morphologiquement normaux. L’une des méthodes couramment utilisée est la centrifugation des spermatozoïdes auà travers d’un gradient de densité (PureSperm) : les spermatozoïdes de faible densité (morts, anormaux) ainsi que les contaminants cellulaires de l’éjaculat s’accumulent dans les fractions de densité correspondante, alors que les spermatozoïdes de plus forte densité (mobiles, normaux) traversent le gradient et se retrouvent dans le fondculot du tube. Les spermatozoïdes ainsi isolés sont lavés avec du milieu de culture afin d’éliminer toute trace de PureSperm.
Spermatozoïdes épididymairesLes spermatozoïdes de l’épididyme peuvent être aspirés et congelés avant le cycle de traitement de la femme. Il est aussi possible que l’aspiration épididymaire se fasse le même jour que le recueil des ovocytes.
Spermatozoïdes testiculairesLa biopsie testiculaire est déchirée en petits morceaux pour permettre la libération de spermatozoïdes dans le milieu. Seuls les spermatozoïdes matures sont utilisés pour l’ICSI. A l’heure actuelle en Suisse, nous n’utilisons pas les spermatides qui sont des cellules germinales haploïdes encore immatures. La biopsie peut être prélevée avant le cycle de traitement de la femme et les spermatozoïdes congelés.
Mise en fécondation des ovocytes
La FIV - fécondation in vitro traditionnelle
Les ovocytes sont mis en présence de nombreux spermatozoïdes mobiles dont un seul va habituellement féconder l’ovocyte. Les ovocytes prélevés par ponction folliculaire sont placés individuellement ou par groupe de 2 ou 3 dans 0,5 ml de milieu de culture. Les spermatozoïdes préparés sont ajoutés aux ovocytes (50’000-100’000 spermatozoïdes mobiles/ml). Pendant les heures qui suivent, certains spermatozoïdes vont traverser le cumulus et s’attacher à la zone pellucide qui entoure l’ovocyte. La zone pellucide est une barrière importante et le spermatozoïde doit exercer des mouvements vigoureux pour la traverser. En général, un seul de ces spermatozoïdes parvient à traverser la zone pellucide, atteindre la surface de l’ovocyte et pénétrer dans l’ovocyte. Bien que la mobilité du spermatozoïde soit essentielle pour qu’il parvienne jusqu’à l’ovocyte, la morphologie du spermatozoïde semble également importante pour assurer le succès de la fécondation in vitro.

Ovocytes en contact avec des spermatozoïdes
L’ICSI - « intracytoplasmic sperm injection »Avec cette technique, un spermatozoïde est directement injecté dans l’ovocyte à l’aide de pipettes en verre très fines. Un microscope équipé d’une excellente optique et une paire de micromanipulateurs sont nécessaires pour l’ICSI.

Technicien procédant à une ICSI
Préparation des ovocytesIl est nécessaire que l’ovocyte soit bien visible pour permettre l’injection d’un spermatozoïde. Pour cela, les cellules du cumulus qui entourent l’ovocyte sont éliminées en utilisant une enzyme appelée hyaluronidase.
Détermination de la maturité de l’ovocyteSeul un ovocyte mature peut être fécondé. L’ovocyte mature se trouve en métaphase de la seconde division méiotique (métaphase II) et se caractérise par la présence du 1er globule polaire dans l’espace périvitellin (entre la surface de l’ovocyte et la zone pellucide). L’ovocyte totalement immature se trouve au stade diplotène de la prophase I et présente un grand noyau appelé vésicule germinale. L’ovocyte en cours de maturation se trouve à un stade intermédiaire de la méiose; il n’a plus de vésicule germinale mais le 1er globule polaire n’est pas encore apparu. La maturation de l’ovocyte se fait dans l’ovaire en réponse à l’hCG injecté pour le «déclenchement» de l’ovulation. Elle est en général achevée lors du recueil des ovocytes mais il arrive que quelques uns des ovocytes soient encore immatures. Les ovocytes immatures représentent en général une faible proportion des ovocytes récoltés. Ces ovocytes sont laissés en culture et ne sont injectés que s’ils parviennent à maturité in vitro.

Ovocyte et son globule polaire
Sélection du spermatozoïdeLes spermatozoïdes mobiles et si possible de morphologie normale sont choisis pour être injectés. La mobilité est importante car elle signale que le spermatozoïde est vivant. Pour ralentir la vitesse de déplacement des spermatozoïdes, on ajoute du polyvinyilpyrrolidone (PVP, 10%) à la suspension juste avant usage. Une goutte (5 µl) de cette suspension est déposée sur un support et recouverte d’huile. Sous le microscope, le spermatozoïde sélectionné est immobilisé en comprimant sa queue contre le support avec la pipette d’injection et aspiré dans celle-ci, la queue en premier. L’immobilisation du spermatozoïde est nécessaire pour éviter que des lésions soient induites par les mouvements du spermatozoïde dans le cytoplasme et pour permettre l’activation de l’ovocyte.
Mise en place de l’ovocyteL’ovocyte à injecter est placé dans un goutte de milieu (5 µl) recouverte d’huile et maintenu en place avec une pipette de contention («holding pipette»). Le 1er globule polaire est placé à 6h de telle sorte que le fuseau méiotique, sur lequel sont disposés les chromosomes maternels et qui est en général proche du globule polaire, ne se trouve pas sur la trajectoire de la pipette d’injection.
Pénétration de la membrane plasmique (oolemma) et injection du spermatozoïdeL’oolemma n’est pas toujours facile à percer avec la pipette d’injection. Pour faciliter la rupture de l’oolemma, la pipette d’injection contenant le spermatozoïde est enfoncée profondément dans l’ovocyte et un peu du cytoplasme est immédiatement aspiré jusqu’à ce que la membrane de l’ovocyte se rompe. A ce moment le cytoplasme aspiré est doucement réinjecté dans l’ovocyte et le spermatozoïde déposé dans le cytoplasme avec un minimum de milieu. La pipette d’injection est délicatement retirée, et l’ovocyte est libéré de la pipette de contention et immédiatement mis en culture.
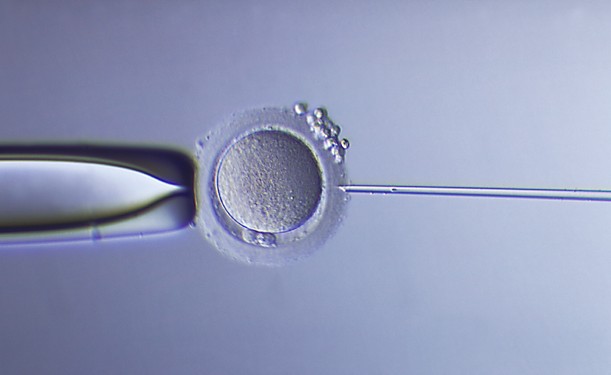
Le spermatozoïde est dans la pipette de micro-injection
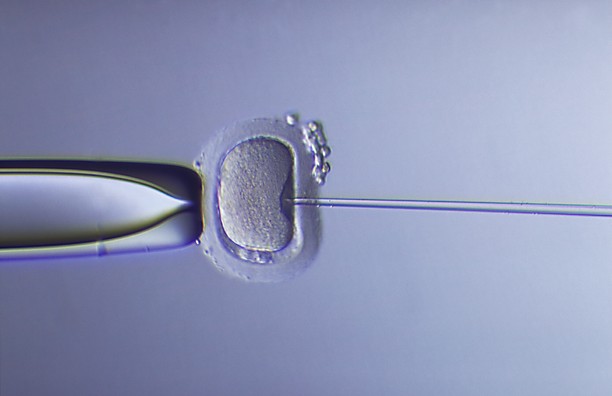
La pipette de micro-injection perce la membrane de l'ovocyte
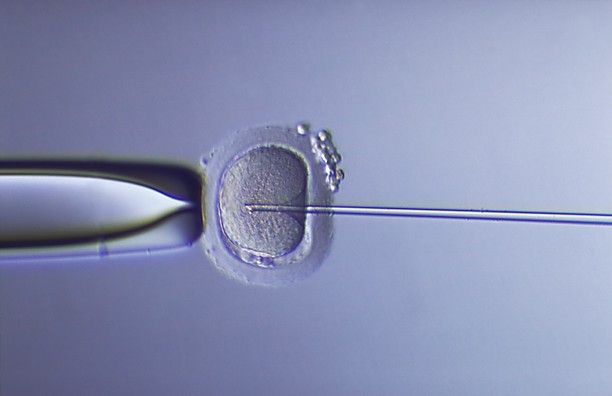
La pipette est engagée jusqu'au centre de l'ovocyte

Le spermatozoïde est introduit dans l'ovocyte

La pipette de micro-injection est retirée laissant une petite cicatrice qui disparaîtra rapidement
Observation de la fécondation (Jour 1)Il est important de déterminer que la fécondation a eu lieu et qu’elle est normale. La fécondation normale se traduit par l’expulsion du 2ème globule polaire dans l’espace périvitellin et la présence de 2 pronuclei dans l’ovocyte. Les pronuclei contiennent le matériel génétique du père et de la mère respectivement. Les pronuclei peuvent apparaître quelques heures après l’insémination conventionnelle ou l’ICSI et sont souvent encore visibles 20h plus tard. Par commodité, les ovocytes sont généralement observés le lendemain du recueil ovocytaire, 14 à 18h après l’insémination. Les ovocytes fécondés sont également appelés zygotes.

Ovocyte fécondé présentant 2 pronuclei et 2 globules polaires
Après une FIV conventionnelle, les cellules qui sont encore associées à l’ovocyte (la corona radiata) doivent être détachées pour que le cytoplasme soit visible. Des mouvements de va-et-vient de l’ovocyte dans une pipette ayant un diamètre légèrement supérieur à l’ovocyte permettent le détachement des cellules de la corona radiata. Cette procédure s'appelle la décoronisation.
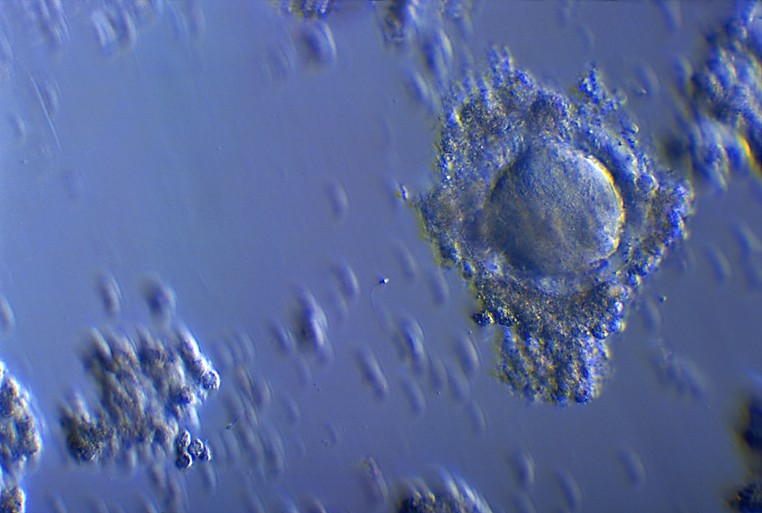
Oocyte entouré de la corona radiata

Aspiration de l'ovocyte dans la pipette
Détachement des cellules de la corona radiata
Zygotes surnumérairesDans de nombreux cas, le nombre de zygotes obtenus est supérieur au nombre maximum d’embryons qui seront transférés dans l’utérus, à savoir 2 ou 3. Par conséquent, 2 ou 3 zygotes sont maintenus en culture en vue du transfert alors que les autres (zygotes surnuméraires) sont congelés. Ces zygotes congelés pourront être transférés dans l’utérus lors d’un cycle ultérieur.
Echec de fécondationBien que nous n’en connaissions pas toutes les raisons, un échec de fécondation peut se produire. En FIV conventionnelle, les spermatozoïdes peuvent présenter une anomalie (mobilité insuffisante, morphologie altérée, présence d’anticorps, anomalie non définie) qui les empêchent de féconder l’ovocyte. L’immaturité des ovocytes peut aussi être une cause d’échec de fécondation.
Bien qu’un échec de fécondation soit rare après ICSI, il se rencontre plus fréquemment lorsque seuls quelques ovocytes ont été injectés (de 1 à 3). L’absence d’activation de l’ovocyte, due à une anomalie de l’ovocyte ou du spermatozoïde, semble être la cause la plus probable de l’échec de fécondation après ICSI. Cependant pour un couple donné, un échec de fécondation dans un cycle ICSI ne signifie pas forcément qu’un second échec aura lieu lors d’un traitement ultérieur.
La fécondation est anormale lorsque plus de 2 pronuclei sont présents. Dans la FIV conventionnelle, ce phénomène est très probablement du à l’entrée de plusieurs spermatozoïdes dans l’ovocyte alors que dans l’ICSI, on pense que l’absence d’émission du 2ème globule polaire de l’ovocyte en est la cause. La présence d’un seul pronucleus est également une situation anormale car il s’agit d’une activation du développement se produisant sans le concours du spermatozoïde. Les ovocytes fécondés anormalement ne sont jamais utilisés pour le traitement.

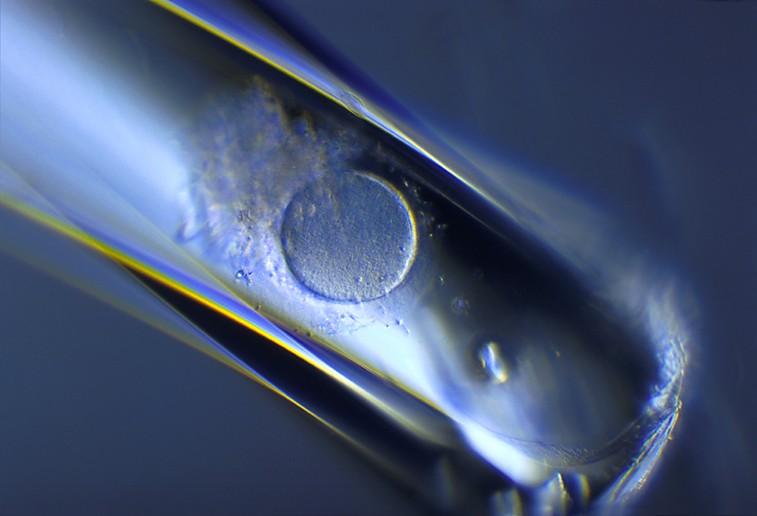
Ovocyte triploïde (avec 3 pronuclei)
Développpement embryonnaire (Jour 2-6)La disparition des pronuclei indique que les chromosomes paternels (amenés par le spermatozoïde fécondant) et maternels (présents dans l’ovocyte) se sont regroupés pour former le génome embryonnaire et que l’ovocyte fécondé se prépare à la 1ère division cellulaire. Les premières divisions sont visibles le lendemain de l’observation des pronuclei. En général, l’embryon présente 2 à 4 blastomères au jour 2, 4 à 8 blastomères au jour 3 et atteint le stade du blastocyste aux jours 5 ou 6. Le blastocyste est le stade auquel l’embryon s’implante dans l’utérus. Bien que la plupart des zygotes atteignent les premiers stades de division (2-4 blastomères), environ la moitié donnera des blastocystes. Notre pratique est de laisser les embryons en culture jusqu’au jour 3 avant de les transférer dans la cavité utérine.

Embryon à 2 blastomères

Embryon à 4 blastomères

Embryon à 16 blastomères (morula)
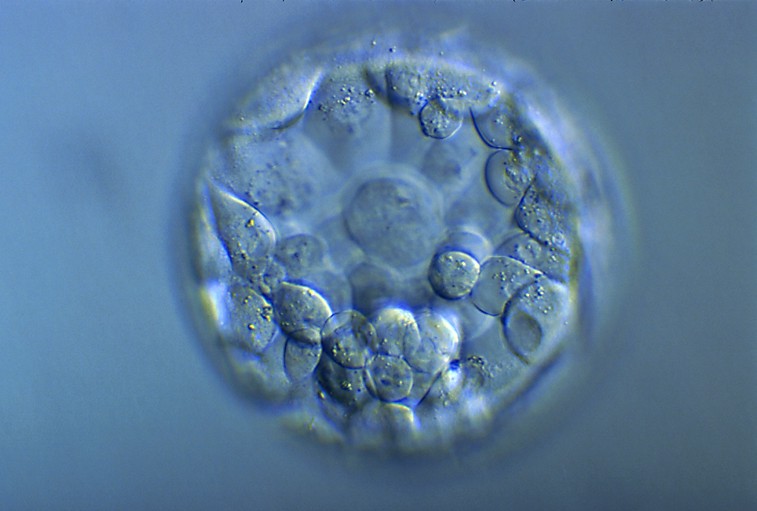
Blastocyste
Transfert d’embryons (Jour 3)Les embryons sont transportés du laboratoire à la salle de transfert qui est équipée d’une petite hotte à flux laminaire chauffante et d’un microscope. Cette installation nous permet de placer les embryons dans le cathéter de transfert juste à côté de la patiente. Le transfert d’embryons a lieu en général au jour 3, lorsque les embryons ont 4 à 8 blastomères. Au maximum 3 embryons sont transférés dans la cavité utérine à l’aide d’ un cathéter. Sous le microscope, les embryons sont aspirés dans le cathéter avec un minimum de milieu de culture. Le médecin introduit ensuite rapidement le cathéter dans la cavité utérine et dépose les embryons dans celle-ci.
Congélation des embryonsD’un point de vue biologique, la congélation des embryons peut se faire à différents stades: lors des premières divisions cellulaires (2-4 blastomères) ou au stade du blastocyste. La congélation peut également se faire au stade du zygote, lorsque les 2 pronuclei sont présents (à ce stade, il ne s’agit pas encore d’un embryon). Malheureusement, avec les techniques dont nous disposons actuellement, il n’est pas possible de congeler des ovocytes sans les endommager.
Dans notre laboratoire, nous congelons les zygotes surnuméraires le jour de l’observation de la fécondation (jour 1). Afin de ne pas endommager le zygote et de préserver son potentiel de développement, il faut le congeler avant la syngamie, c’est-à-dire avant la disparition des pronuclei, et après la synthèse d’ADN, qui a lieu environ 10 à 16h après l’insémination, en prévision de la 1ère division cellulaire. De manière générale, nous congelons les zygotes entre 18 et 20h après l’insémination.
Pour protéger le zygote de la congélation, on ajoute des cryoprotecteurs (1,2-propanediol et sucrose) à la solution de congélation. Après équilibration avec la solution de congélation, les zygotes sont placés dans des paillettes qui sont mises dans un appareil permettant de contrôler très précisément la vitesse de refroidissement et d’induire la cristallisation à un moment déterminé. La congélation se fait très lentement de telle sorte à éviter la formation de gros cristaux de glace à l’intérieur du zygote. Les zygotes sont ensuite conservés à très basse température dans de l’azote liquide (-196 °C).
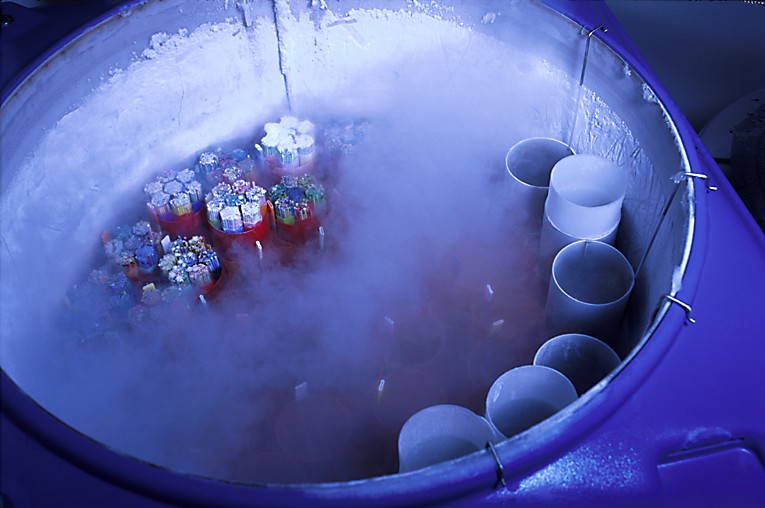
La veille du transfert prévu, les zygotes sont décongelés, lavés pour éliminer les cryoprotecteurs et mis en culture jusqu’au lendemain pour qu’ils effectuent leur première division cellulaire. Bien qu’en moyenne, 75% des zygotes survivent à la congélation, il peut arriver que, pour un couple donné, aucun de leurs zygotes ne survive. Dans ce cas, le transfert est annulé.
Pour en savoir plus sur le laboratoire
Généralités
En dehors du corps humain, les gamètes (spermatozoïdes et ovocytes) et les embryons doivent être maintenus constamment à une température de 37°C, dans un environnement stérile et dans un milieu de culture adéquat. Au laboratoire, des unités chauffantes permettent de garantir une température constante de 37°C. Pour protéger les gamètes et embryons de toute infection, tout le matériel utilisé est stérile et jeté après usage, toutes les manipulations se font dans un environnement stérile sous une hotte à flux laminaire. Les embryons doivent également être à l’abri de tout agent toxique : tout le matériel utilisé qui entre en contact avec le milieu ou les embryons (boîte de Petri, tubes, pipettes, seringue, cathéter) doit être par conséquent soigneusement sélectionné. Une attention particulière est apportée à l’identification des patients :le nom de la patiente est inscrit sur toutes les boîtes, tubes ou paillettes contenant ses gamètes ou embryons.
Culture embryonnaireLa culture des embryons se fait dans des petites gouttes (20μl) de milieu de culture déposées au fond d’une boîte de Petri et recouvertes d’huile pour éviter l’évaporation, limiter les échanges gazeux et protéger des contaminations. Les boîtes sont gardées dans un incubateur dont la température est fixée à 37°C et dont l’air est enrichi en CO2 (5%). Pour éviter de les perturber, l’observation des embryons au microscope est limitée au strict minimum . Lorsque les embryons doivent être déplacés ou changés de milieu, ils sont manipulés à l’aide d’une pipette en verres très fines (la taille d’un embryon représente environ un dixième de millimètres) sous une loupe binoculaire équipée d’un plaque chauffante, dans un environnement stérile.
Milieux de cultureLes milieux de culture jouent un rôle très important dans la FIV car ils apportent les éléments métaboliques nécessaires à la survie des gamètes et permettent aux phénomènes biologiques (tels que la mobilité des spermatozoïdes, la fécondation, les divisions cellulaires, l’activation génomique, la différenciation des cellules embryonnaires et du trophectoderme) de se produire normalement. Le spermatozoïde, les ovocytes et les embryons n’ont pas tous les mêmes besoins métaboliques, de plus les besoins varient en fonction des étapes du développement. C’est pour cela que l’utilisation de milieux de culture, adaptés à des étapes particulières du développement in vitro et que l’on appelle « séquentiels », tend à se généraliser dans les laboratoires FIV. Dans notre laboratoire, nous utilisons un milieu pour la fécondation et un autre pour le développement jusqu’au stade de 8 blastomères.